К.ЗАХАРИЕВА, ЗООИНЖ. Д-Р Н. ЛУКАНОВА: НАУЧНА ИНФОРМАЦИЯ: Епигенетика и нейното място в животновъдния сектор
Епигенетиката е въведена като термин за първи път от Конрад Хал Уодингтън (1905–1975), като корена на думата идва от аристотеловия термин „епигенеза“. Представката „епи-“ произлиза от гръцката επί-, която означава: над, извън, около. Терминът епигенетика включва всяка модификация в експресията на гени, дължаща се на различни фактори и се различава от обикновена мутация в ДНК последователността. Факторите на епигенетика включват: ДНК метилиране, пост-транслационна модификация на хистони, но също така са свързани с регулиране на генната експресия чрез некодиращи РНК, дестабилизирани геномни участъци или всяка друга намеса, която може да предизвика модификация на фенотипа. Има малко доказателства за съществуването на трансгенерационно епигенетично унаследяване при бозайници, което обикновено включва и факторите на околната среда, действащи едновременно върху индивида, развиващия се плод и зародишните клетъчни линии. Тези фактори, включени в епигенетиката влияят и на клетъчната енергия и състоянието на клетките.
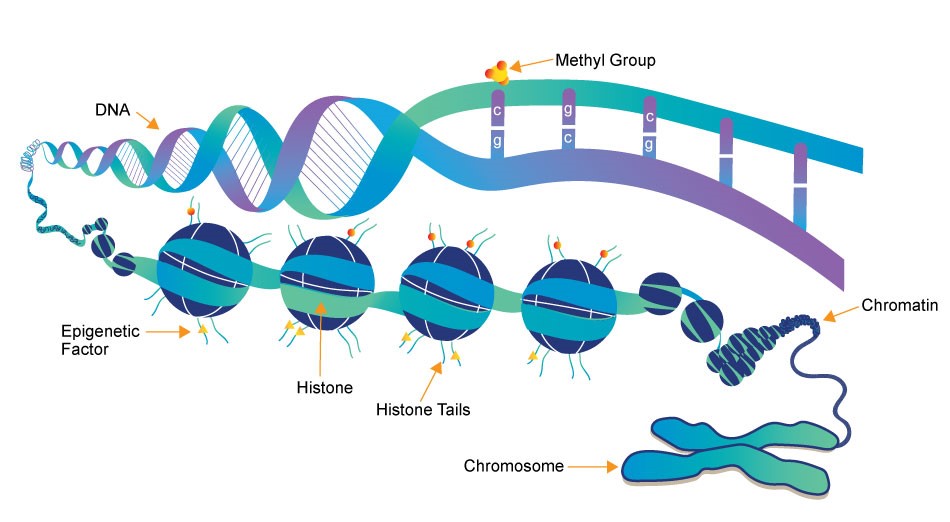
Фиг. 1: Схематично представени епигенетични фактори
Епигенетична информация е информацията в генома, която се унаследява от клетките, но не е включена в нуклеотидната последователност на ДНК. Епигенетичното унаследяване (известно още като не генетично унаследяване или трансгенерационни епигенетични ефекти) се отнася до всяка модификация на фенотипа на поколенията, която се дължи на предаването на епигенетични последователности/информация, различни от ДНК информацията от родителската двойка или предците (Bonduriansky and Day, 2009).
Усилията за разбиране на епигенетиката при животните са съсредоточени най-вече върху молекулярните епигенетични фактори, които регулират експресията на определени гени или геномни райони, понякога в отговор на външни фактори на околната среда както и начин на живот и поведение или климатични промени. До момента има малко информация и още по-малко научна литература относно трансгенерационното епигенетично унаследяване, а възможните стратегии за използване на епигенетиката в животинските популации все още не са описани. Оскъдното количество епигенетични данни за целия геном и високата цена на скрининга на епигенотипа на индивидите са ограничаващи фактори за разработване на изследвания в това направление.
Съществуват противоречия относно възможността за унаследяване на епигенетичната информация. Трябва да се поясни, че обикновено се посочват два вида епигенетично унаследяване: i) епигенетични белези, които могат да бъдат унаследени в соматичните клетъчни линии, тъй като тези белези се съхраняват по време на митозата (Jablonka Raz, 2009) и ii) трансгенерационното епигенетично унаследяване в зародишната линия клетки, която контролира модели на генна експресия, предавани от едно поколение на друго (Daxinger and Whitelaw, 2012).
Последните проучвания съобщават, че епигенетичното унаследяване играе решаваща роля във фенотипните вариации по време на индивидуалното развитие и това на поколенията след тях (Nilsson et al., 2018).
Има хипотеза, че след като епигенетичните белези могат да се предават на поколенията чрез мейоза и митоза, това би важало и при бозайниците. Но за тази хипотеза има доста възникнали съмнения, основно засягащи обширното епигенетично препрограмиране, което настъпва два пъти при бозайниците ‒ веднъж по време на образуването на гаметите и втори път след тяхното сливане и образуване на ембрион, който ще бъде имплантиран. Тези събития водят до „изтриване или нулиране“ на епигенетичната информация, която е придобита от родителите, така че новото поколение да започне „на чисто“(John R.M. and Rougeulle C., 2018).
Епигенетичните изследвания разглеждат модификации и модели на унаследяване, които не включват промени в последователността на ДНК, но влияят върху активността на генната експресия. Има четири основни фактора, чрез които епигенетиката може да променя генната експресия. Това са: 1) ДНК метилиране (ДНКм), 2) модификации на хистони, 3) ремоделиране на хроматинова структура и 4) регулиране на некодираща РНК (фиг. 1).

